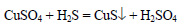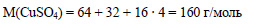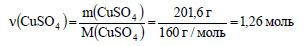Решение:
В осадок выпадает сульфид меди (II):
Вычислим количество вещества сероводорода:
Вычислим массу раствора сульфата меди:
Вычислим массу сульфата меди в растворе:
Определим молярную массу сульфата меди:
Вычислим количество вещества сульфата меди:
По уравнению реакции 1 моль сероводорода реагирует с 1 моль сульфата меди, значит в реакцию с 1,036 моль сероводорода вступит 1,036 моль сульфата меди, то есть сульфат меди взят в избытке и расчет ведем по сероводороду. По уравнению реакции из 1 моль сероводорода образуется 1 моль сульфида меди (II), значит из 1,036 моль сероводорода образуется 1,036 моль сульфида меди (II). Вычислим молярную массу сульфида меди (II):
M(CuS) = 64 + 32 = 96 г/моль.
Вычислим массу сульфида меди (II):
m(CuS) = ν(CuS) · M(CuS) = 1,26 моль · 96 г/моль ≈ 120,96 г.
Ответ: В осадок выпадает 121 г сульфида меди (II).
 Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
задача №3
к главе «Глава V. Металлы».