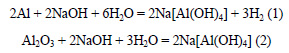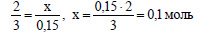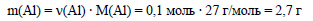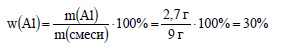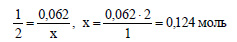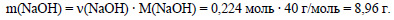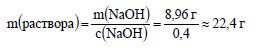Решение:
Уравнения реакций:
Вычислим количество вещества выделившегося водорода:
По уравнению реакции при взаимодействии 2 моль алюминия с раствором щелочи выделяется 3 моль водорода. Пусть 0,15 моль водорода выделится при реакции x моль алюминия с раствором щелочи. Составим пропорцию:
Молярная масса алюминия равна 27 г/моль, вычислим массу алюминия:
Вычислим массовую долю алюминия в смеси:
Вычислим массовую долю оксида алюминия в смеси:
По уравнению (1) 2 моль алюминия реагирует с 2 моль гидроксида натрия, значит 0,1 моль алюминия реагирует с 0,1 моль гидроксида натрия. В смеси содержится 9 – 2,7 = 6,3 г оксида алюминия. Вычислим молярную массу оксида алюминия:
Вычислим количество вещества оксида алюминия:
По уравнению реакции (2) 1 моль оксида алюминия реагирует с 2 моль гидроксида алюминия. Пусть 0,062 моль оксида алюминия реагирует с х моль гидроксида натрия. Составим пропорцию:
Таким образом, всего необходимо 0,1 + 0,124 = 0,224 моль гидроксида натрия. Определим молярную массу гидроксида натрия:
Вычислим массу гидроксида натрия:
Вычислим массу раствора гидроксида натрия с концентрацией 40%, или 0,4.
Вычислим объем раствора: гидроксида натрия:
Ответ: в смеси содержится 30% алюминия и 70% оксида алюминия; потребуется 16 мл раствора гидроксида натрия.
 Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
задача №4
к главе «Глава V. Металлы».