Задания. 1. Получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. Изучите некоторые физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде, относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;
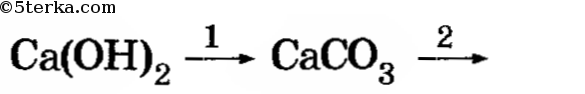
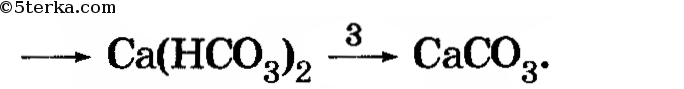
4. Распознайте известняк среди выданных образцов минералов.
5. Получите карбонат бария с помощью реакции обмена.
Оборудование. Прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
Вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
Выполнение работы
1. Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
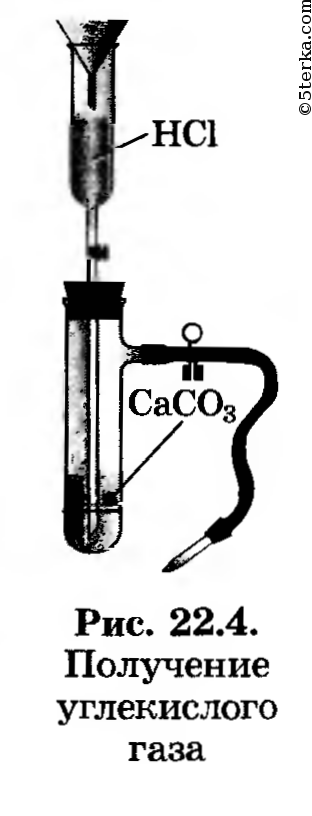
2. Изучение свойств оксида углерода (IV). Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
Налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте уравнение соответствующей реакции. Нагрейте содержимое пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
3. Прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ. Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. В одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. Что вы наблюдаете? Объясните происходящее явление с помощью уравнений реакций. Сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. Из выданных вам минералов с помощью химических реакций определите известняк. Составьте ионные уравнения проделанной реакции.
5. Получите реакцией обмена карбонат бария. Опытным путем докажите, что выпавший осадок действительно является карбонатом. Составьте полные и сокращенные ионные уравнения проделанных реакций.
1.
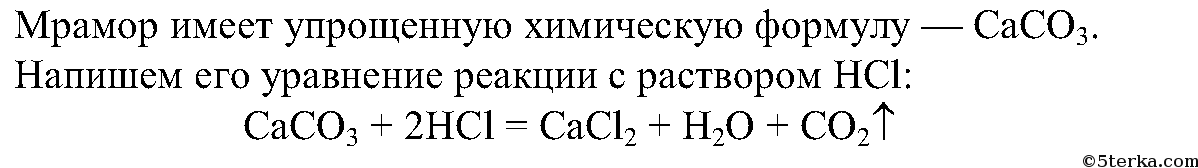
Картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
2.
При внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. Углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.
Физические свойства.

3.
Наблюдается помутнение раствора, на практике это используется при побелке стен. Происходит реакция:
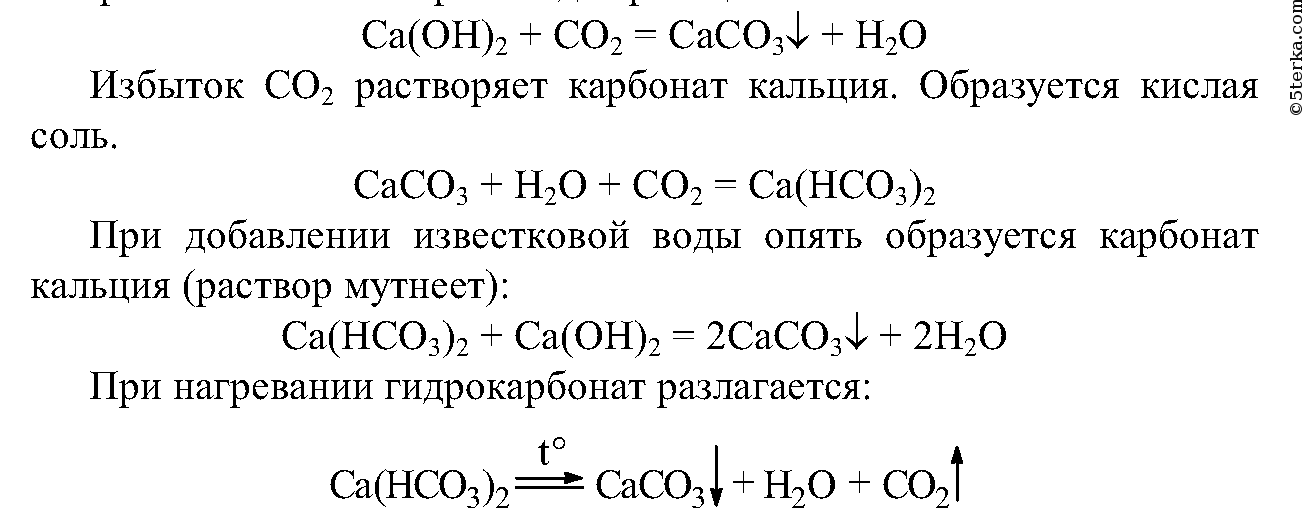
Выводы:
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
4.
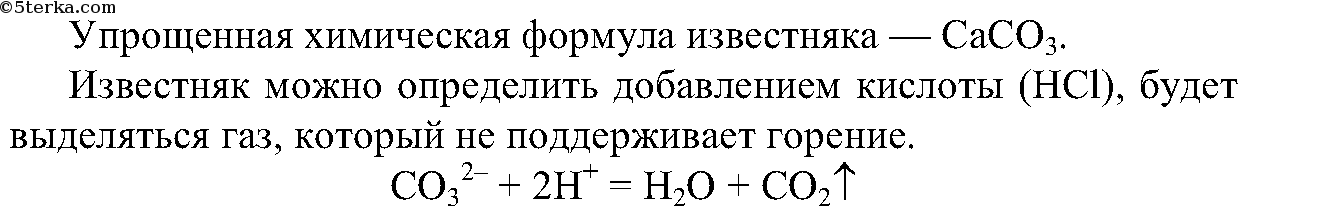
5.
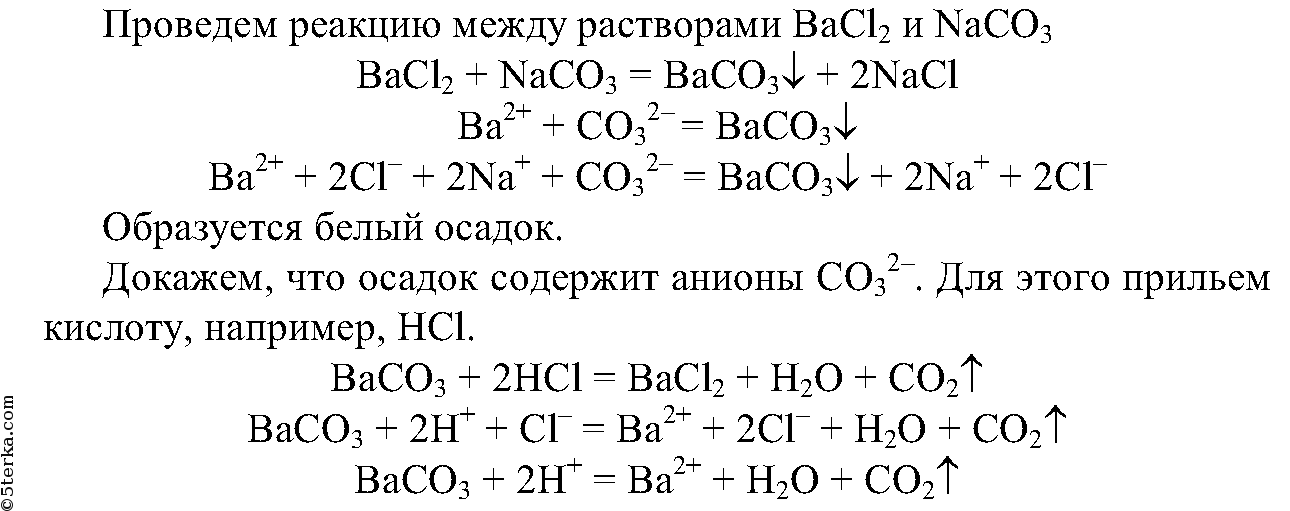
Выделяется газ, который не поддерживает горение.
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №5
к главе «Практические занятия».