Оборудование. Штатив с пробирками, пробиркодержатель, ступка с пестиком, предметные стекла (2 шт.), тигельные щипцы, стеклянные палочки (2 шт.), прибор для получения газов.
Вещества. 10%-е растворы гидроксида аммония и гидроксида натрия; серной и соляной кислот, нитрата и сульфата аммония, хлорида бария; силикат натрия; 1%-й раствор нитрата серебра, раствор лакмуса; кристаллические аммиачная селитра, гидроксид кальция, фосфат натрия, карбонат калия, хлорид аммония; 5% -е растворы хлорида, гидрофосфата и нитрата аммония (соответственно пробирки № 1, № 2, № 3), 10%-е растворы хлорида бария, фосфата натрия и соляной кислоты (соответственно пробирки № 4, № 5, № 6).
Примеры экспериментальных задач
1. С помощью реакций нейтрализации получите: а) сульфат аммония; б) кремниевую кислоту; в) хлорид аммония. Напишите ионные уравнения проделанных реакций.
2. Докажите опытным путем, что в состав: а) хлорида аммония входит ион аммония, б) карбоната натрия входит карбонат-ион, в) сульфата аммония входят ионы аммония и сульфат-ионы. Составьте ионные уравнения проделанных реакций.
3. В трех пробирках (№ 1, № 2 и № 3) находятся растворы хлорида, гидрофосфата и нитрата аммония. Распознайте их с помощью одного и того же реактива. Ответ обоснуйте, написав ионные уравнения реакций.
4. В трех пробирках (№ 4, № 5, № 6) находятся растворы хлорида бария, фосфата натрия и соляной кислоты. Распознайте соляную кислоту, используя только данные растворы. Напишите ионные уравнения проделанных реакций.
5. Опытным путем убедитесь, что перед внесением в почву нитрата аммония нельзя смешивать его с гашеной известью. Напишите уравнение проделанной реакции.
6. Осуществите превращение веществ:
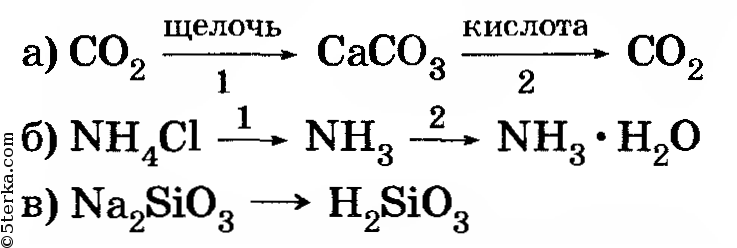
Напишите уравнения проделанных реакций.
7. Определите среду растворов фосфата натрия и карбоната калия.
Напишите ионные уравнения реакций, происходящих в этих растворах.
1.
Реакция нейтрализации — это реакция между кислотой и основанием. Следовательно, нам надо выбрать определенные кислоту и основание, при взаимодействии которых получается необходимое вещество.
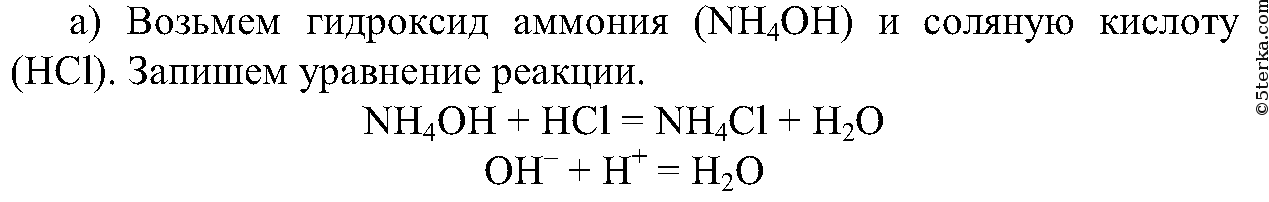

2.


3.

4.
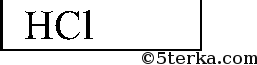
Последовательно приливаем раствор из одной пробирки к растворам 2 других. Есть 2 варианта: выпадает белый осадок или растворы в 2 пробирках не изменятся. В 1-ом случае соляная кислота в той пробирке, в которой осадок не выпал, во втором — соляная кислота — в той пробирке, которую мы доливали к двум другим. Белый осадок Ва3(РO4)2:
3Ва2+ + 6Cl + 6Na+ + 2РO43- = Ва3(РO4)2Р + 6Na+ + 6Cl-
Чтобы проводимые реакции были наглядней, можно составить 2 таблички.
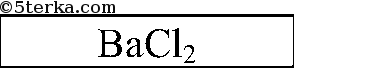 | 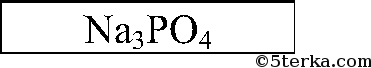 | 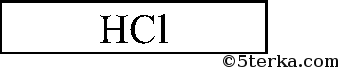 | |
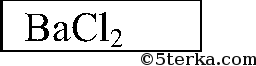 |  | 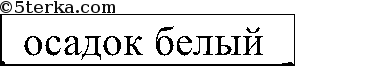 |
— |
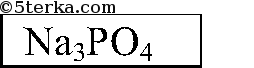 | 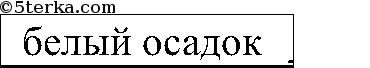 |  |
— |
 |
— |
— |  |
|
№ 4 |
№ 5 |
№ 6 | |
|
№ 4 |  | ||
|
№ 5 |  | ||
|
№ 6 |  |
Тогда та пробирка, с которой ничего не прореагировало, и содержит НCl.
5.
Проведем указанную реакцию.
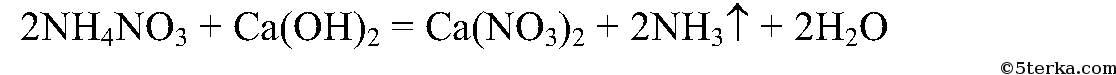
Их нельзя смешивать, т.к. в результате взаимодействия выделяется аммиак.
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №6
к главе «Практические занятия».