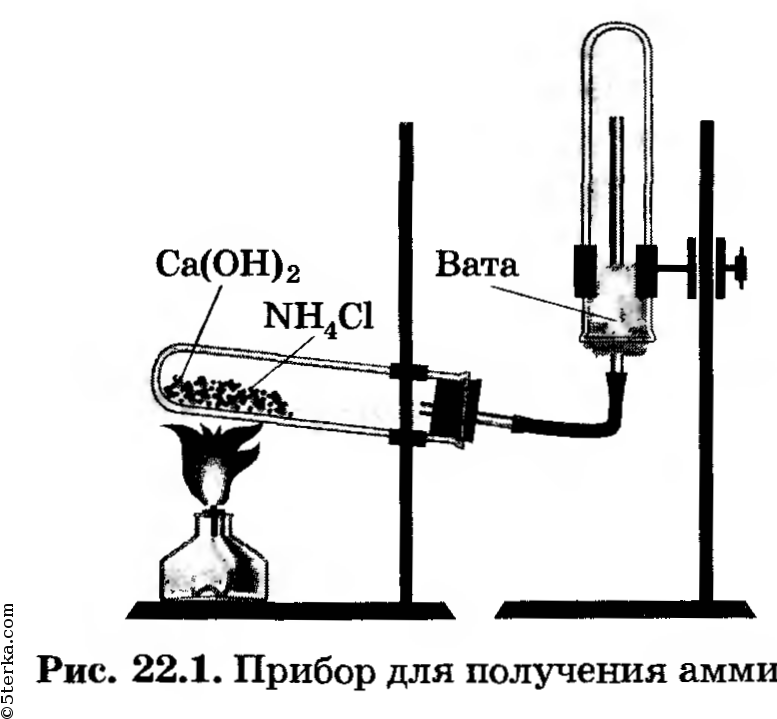
Задания. 1. Получите аммиак по реакции гидроксида кальция с хлоридом аммония.
2. Изучите некоторые физические свойства аммиака (цвет, запах, относительную плотность, растворимость в воде).
3. Изучите взаимодействие аммиака с водой, азотной и соляной кислотами.
4. Проделайте реакции:а) между раствором аммиака в воде и серной кислотой;б) между гидроксидом аммония и раствором хлорида железа (III).
Соблюдайте правила техники безопасности при проведении опытов!
Оборудование. Детали прибора для получения аммиака, лабораторный штатив, штатив с пробирками, фарфоровая ступка с пестиком, ложечка или шпатель, стеклянные палочки (2 шт.), пробка с держателем, нагревательный прибор.
Вещества. Кристаллические гидроксид кальция и хлорид аммония; концентрированная соляная, концентрированная азотная и 20% -я серная кислоты; вода (в стакане), раствор фенолфталеина, раствор хлорида железа (III).
Выполнение работы
Получение аммиака. Соберите прибор для получения аммиака (рис. 22.1), испытайте на герметичность. За
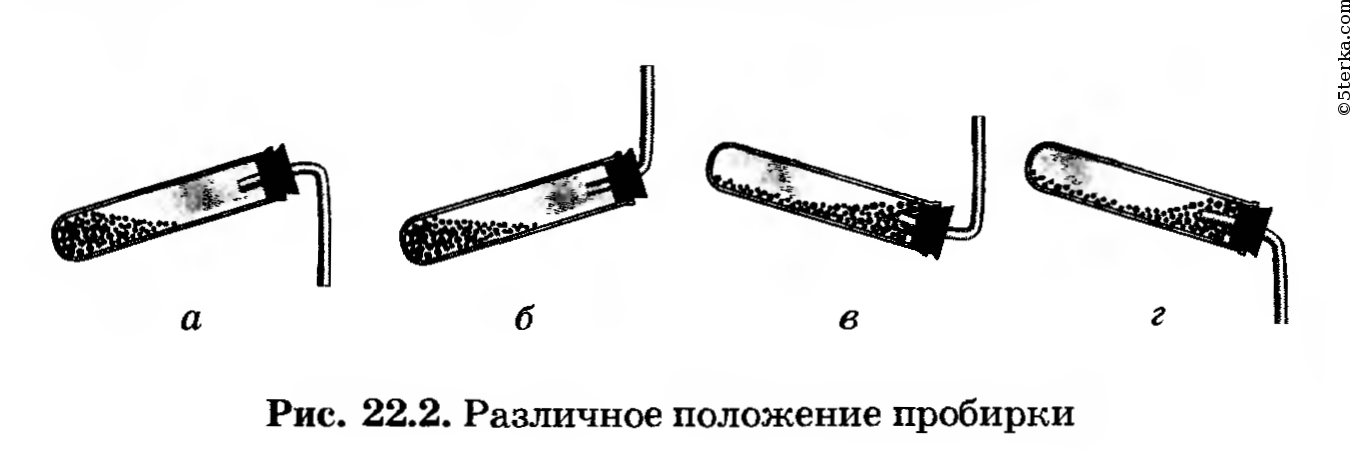
крепите его в штативе так, чтобы удобно было нагревать пробирку. Решите, какое положение пробирки (рис. 22.2, а, б, в или г) является правильным.
Приготовьте три сухих (почему?) пробирки, которые предстоит наполнить аммиаком. Закройте их пробками.
В ступку насыпьте по одной ложечке хлорида аммония и гидроксида кальция, перемешайте их, разотрите пестиком. Затем перенесите порцию смеси в пробирку прибора, заполнив ее не более чем на 1/3.
Начните нагревать содержимое пробирки, при этом сначала обогрейте пламенем горелки всю пробирку, затем пламя направьте так, чтобы нагревалась поверхность смеси.
Наполните три пробирки аммиаком, заткните их пробками с держателями; прекратите нагревание и, не разбирая прибора, перенесите его в вытяжной шкаф.
Изучение свойств аммиака.
1. Исследуйте растворимость, взаимодействие аммиака с водой. Для этого опустите пробирку с аммиаком в стакан с водой и под водой откройте ее, как это показано на рисунке 22.3.
Что вы наблюдаете?
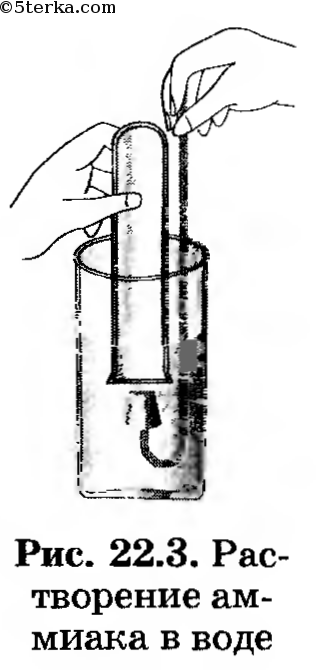
Не вынимая пробирку, закройте ее также под водой пробкой с держателем, после чего поставьте в штатив. К полученному раствору добавьте 2—3 капли раствора фенолфталеина.
Составьте уравнение реакции взаимодействия аммиака с водой.
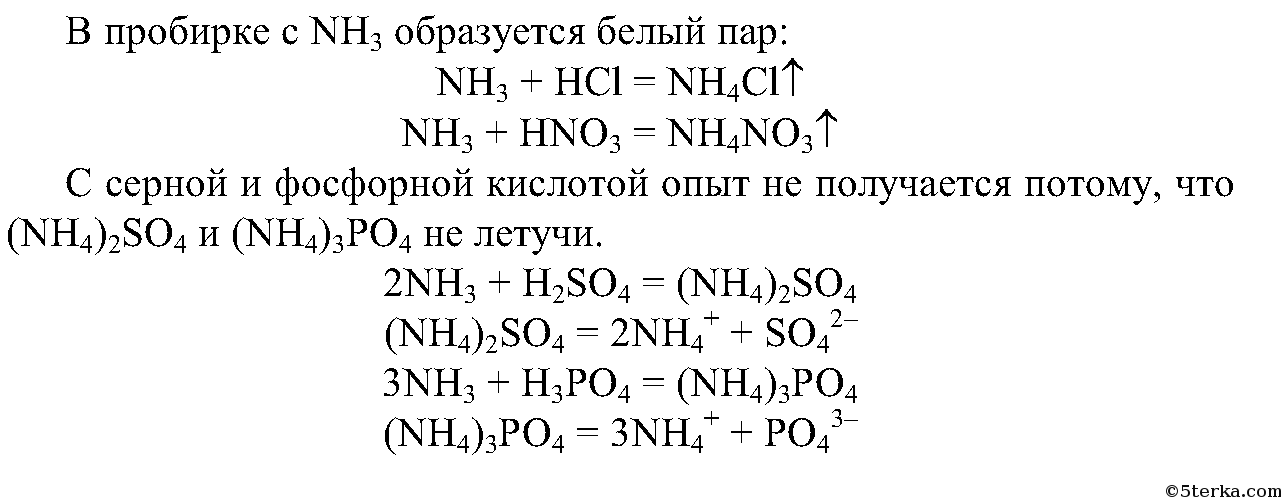
2. Смочите стеклянную палочку концентрированной соляной кислотой, другую — концентрированной азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдаете?
Составьте уравнения происходящих реакций.
Почему опыт не получится при использовании серной и фосфорной кислот?
3. Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдаете?
Составьте уравнения реакций образования сульфата и гидросульфата аммония.
4. В другую пробирку с раствором аммиака добавьте раствор хлорида железа (III). Что вы наблюдаете?
Запишите ионные уравнения реакций.
Получение аммиака:
Правильное положение пробирки под б). Во-первых, NH3 легче, чем воздух, он будет подниматься вверх, поэтому газоотводная трубка должна также быть направлена вверх. Во-вторых, мы будем нагревать вещество в пробирке, поэтому оно не должно соприкасаться с пробиркой, которая от огня может расплавиться.
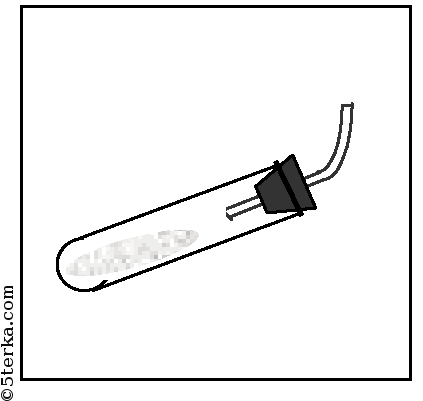
Пробирки должны быть сухими, т.к. аммиак реагирует с водой и в результате образуется гидроксид аммония.
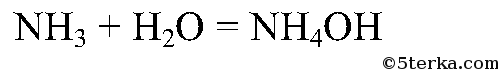
Реакция получения аммиака:
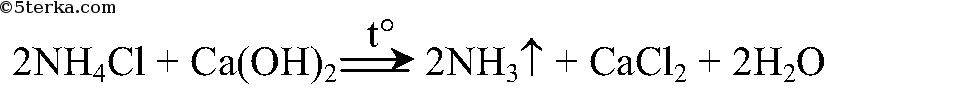
Изучение свойств аммиака:
1.
Аммиак хорошо растворяется в воде:
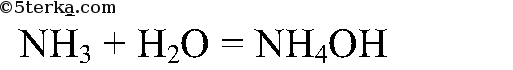

2.
3.
Раствор обесцвечивается, поскольку серная кислота нейтрализует аммиак, т.е. среда становится нейтральной. В нейтральной и кислой среде фенолфталеин бесцветный.
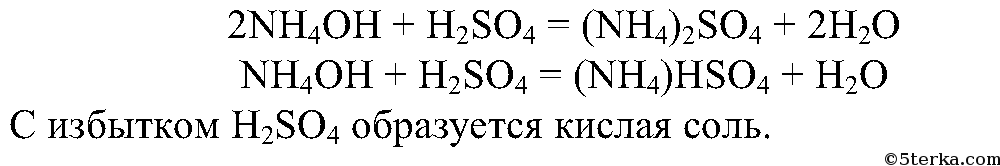
4.
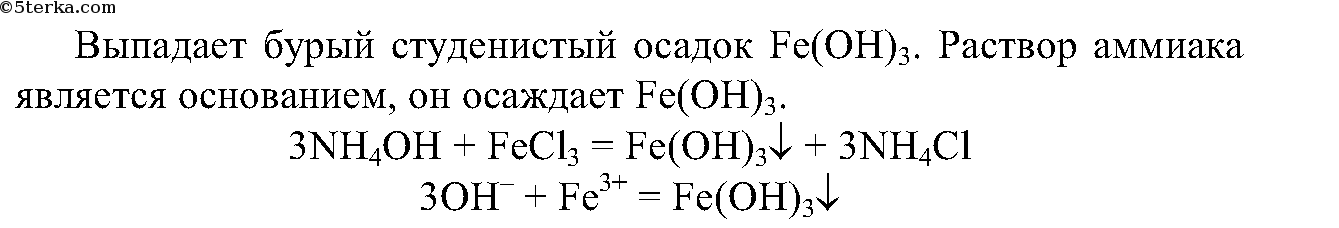
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №3
к главе «Практические занятия».