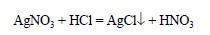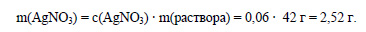Решение:
Вычислим массу раствора нитрата серебра:
Вычислим массу нитрата серебра, содержащегося в растворе:
Определим молярную массу нитрата серебра:
Вычислим количество вещества нитрата серебра:
Вычислим количество вещества хлороводорода:
По уравнению реакции 1 моль хлороводорода реагирует с 1 моль нитрата серебра, значит для реакции с 0,0148 моль нитрата серебра необходимо 0,0148 хлороводорода, а имеется только 0,0112 моль, значит нитрат серебра взят в избытке, расчет ведем по хлороводороду. Из 1 моль хлороводорода образуется 1 моль хлорида серебра, значит из 0,0112 моль хлороводорода образуется 0,0112 моль хлорида серебра. Определим молярную массу хлорида серебра:
Вычислим массу хлороводорода:
Ответ: в осадок выпадает 1,6 г хлорида серебра.
 Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
задача №3
к главе «Глава VI. Неметаллы».