1. Налейте в пробирку 1—2 мл концентрированного раствора серной кислоты и опустите в нее гранулу цинка. Составьте уравнение реакции в молекулярном и ионном видах, покажите переход электронов. Что в этой реакции является окислителем?
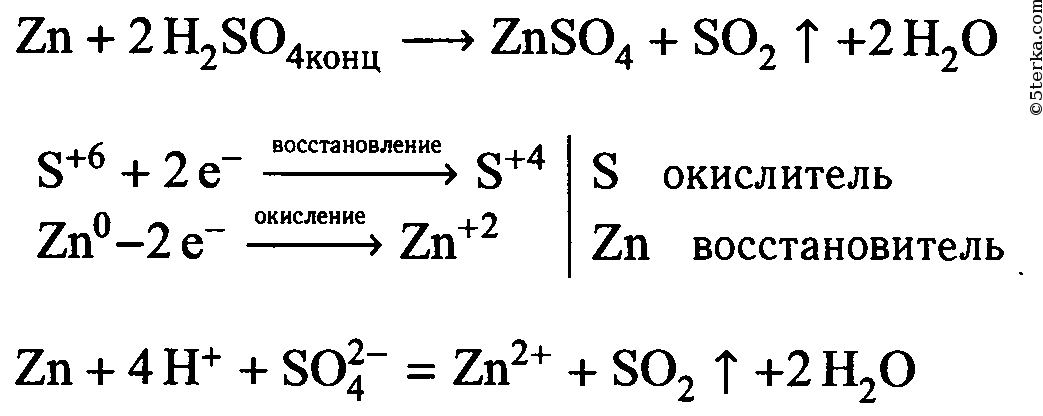
2. В шести пробирках находятся растворы хлорида магния. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном и ионном видах.
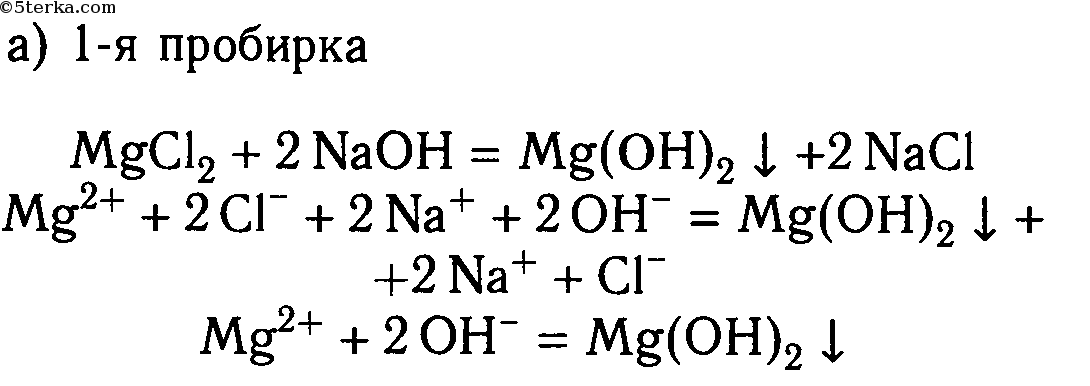
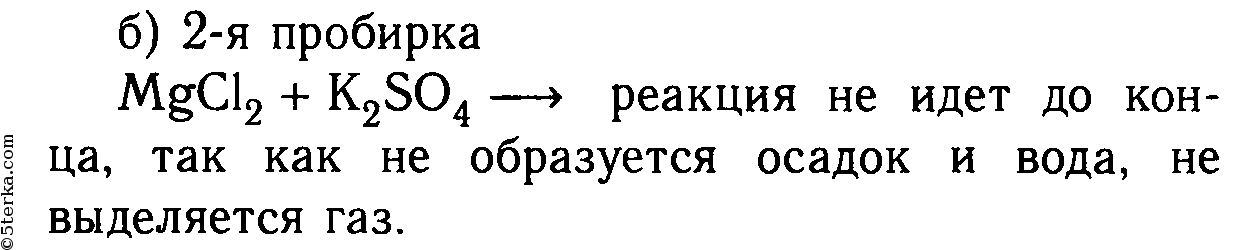
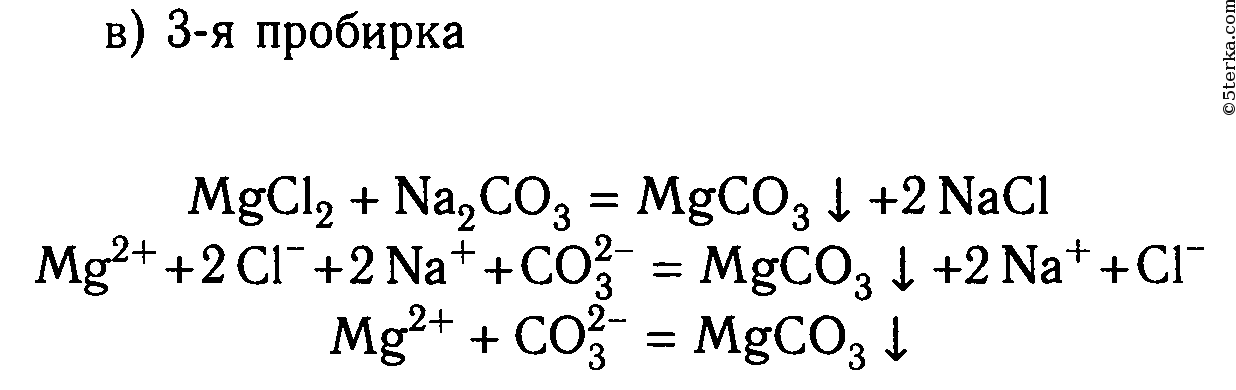
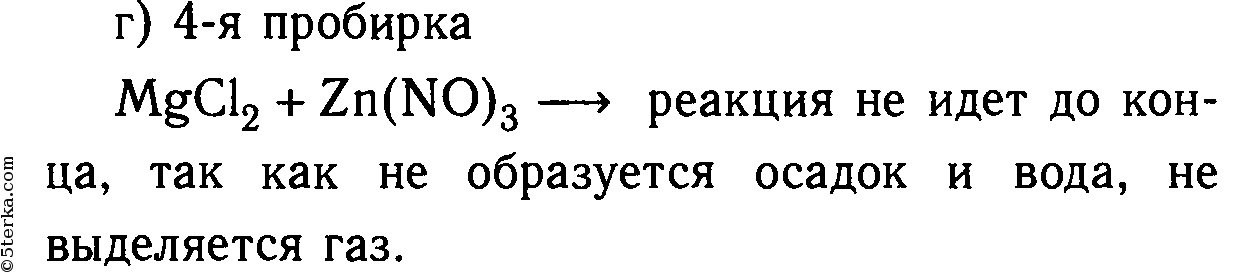
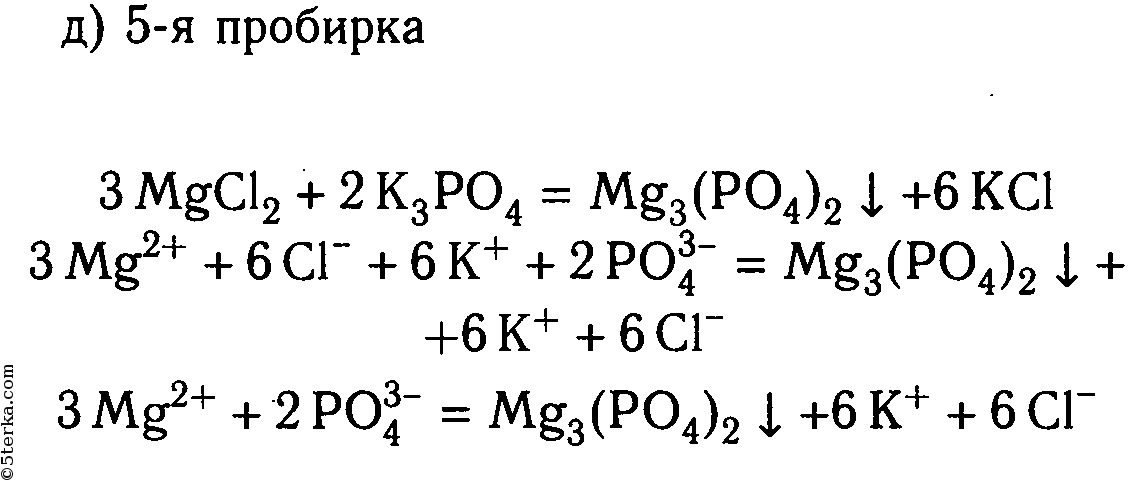
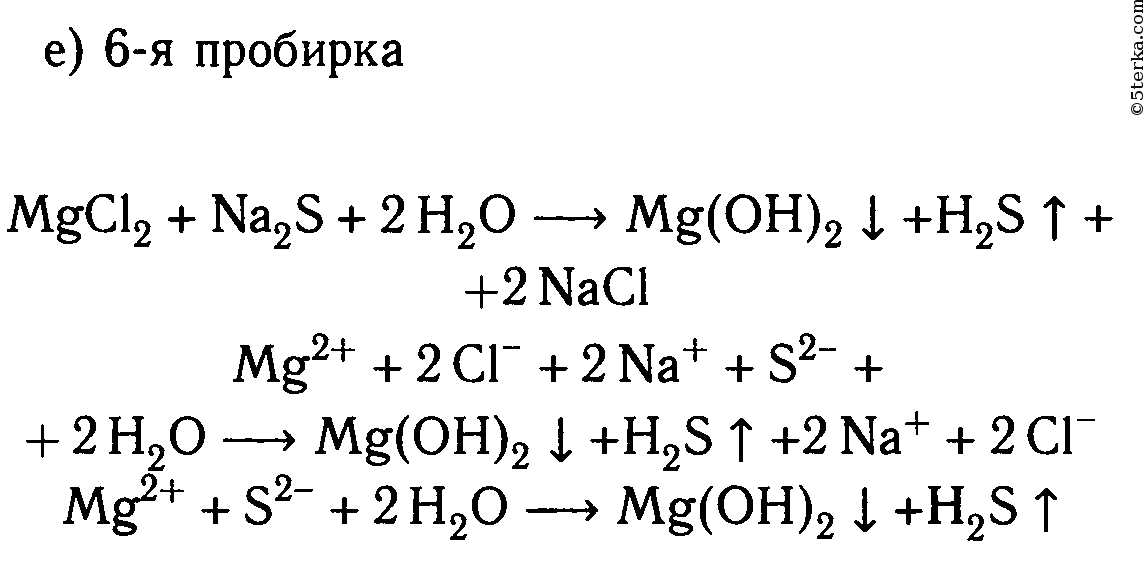
3. Даны растворы: а) карбонат калия и соляная кислота; б) сульфид натрия и серная кислота; в) хлорид цинка и азотная кислота; г) сульфит натрия и серная кислота; д) сульфат меди (II) и азотная кислота.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствующих реакций в молекулярном и ионном видах.
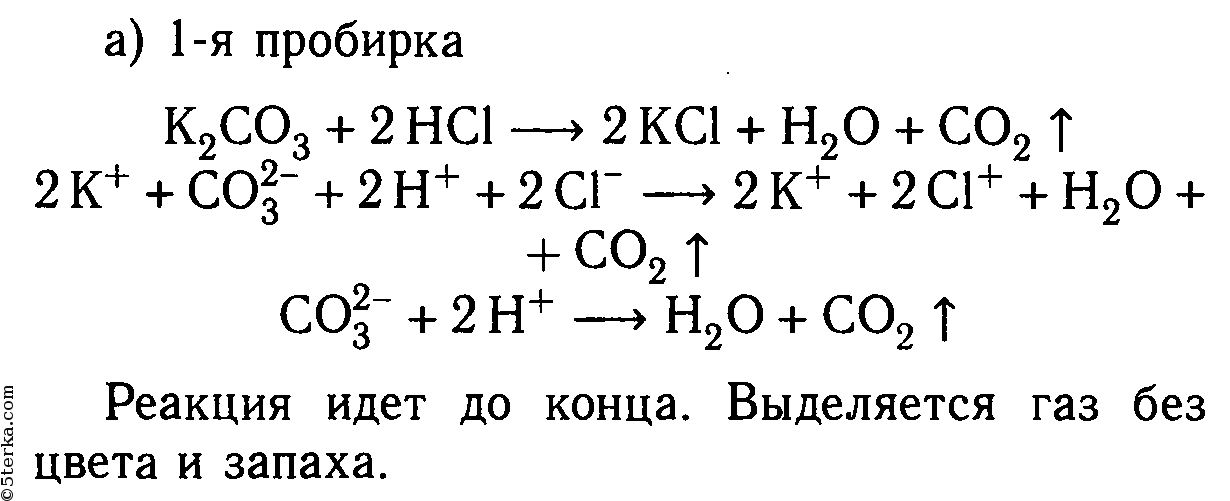
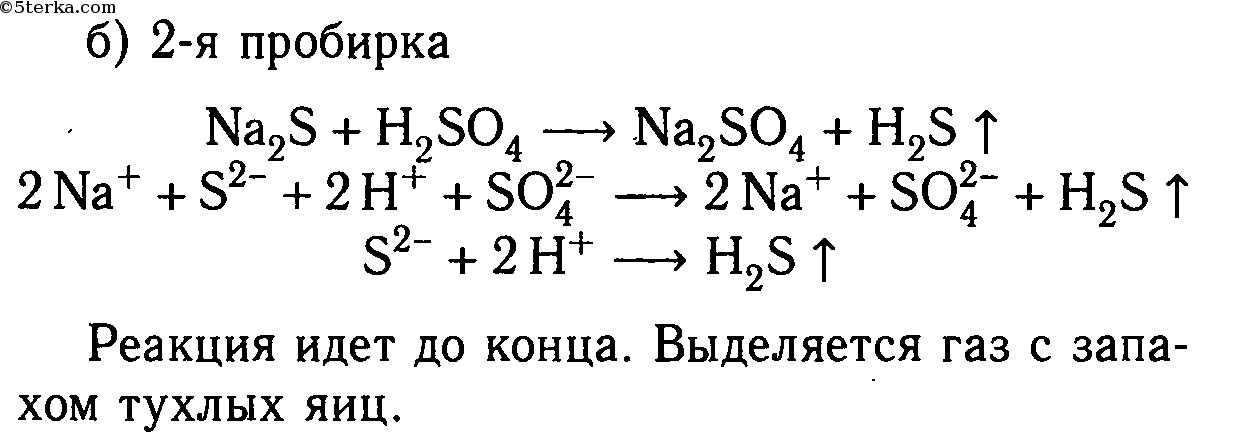

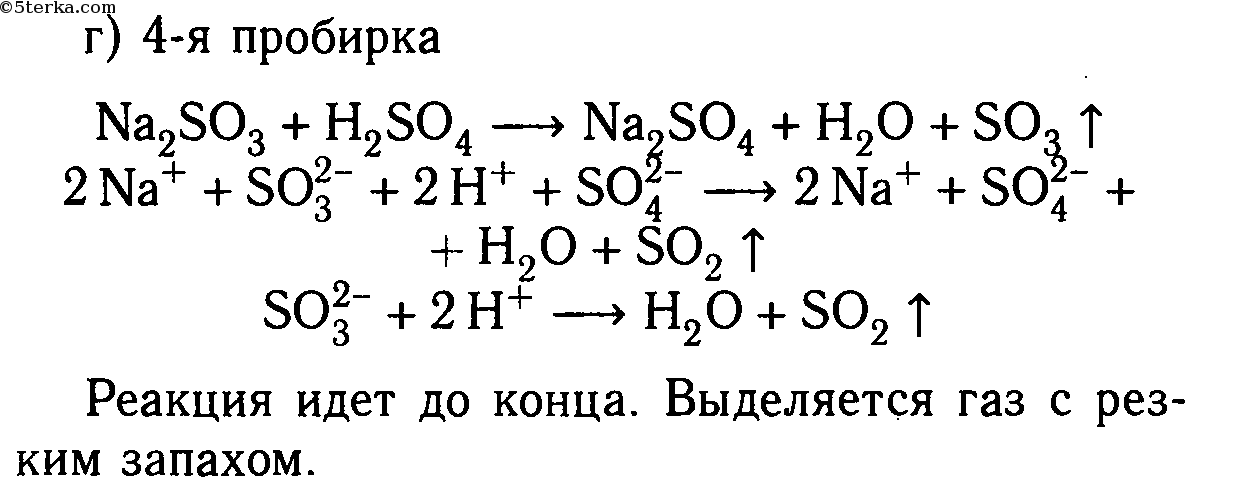

4. Осуществите реакции, схемы которых:
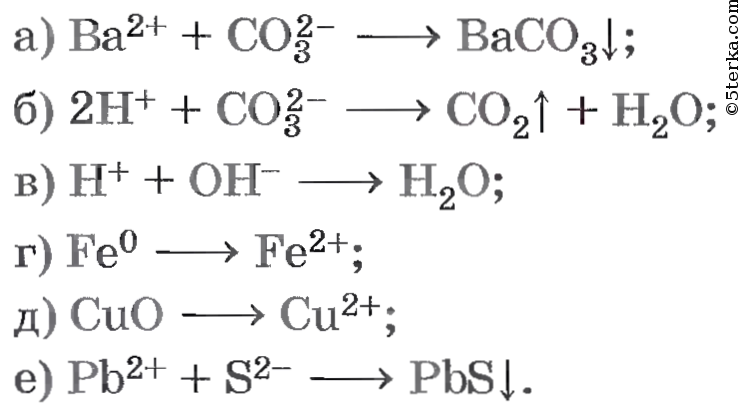

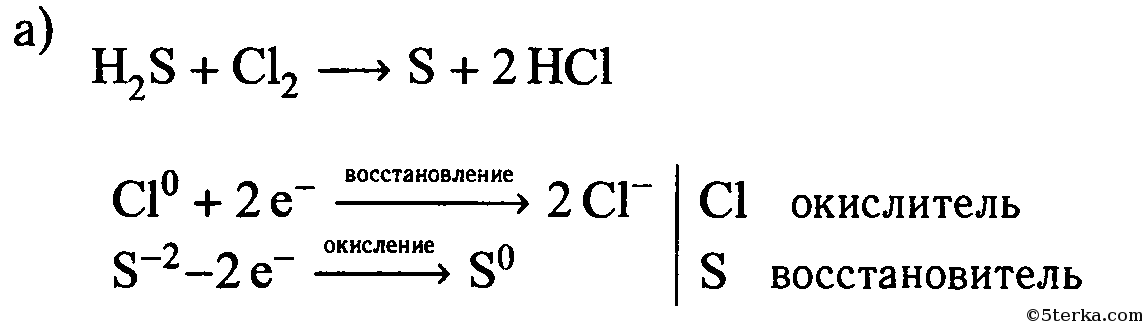
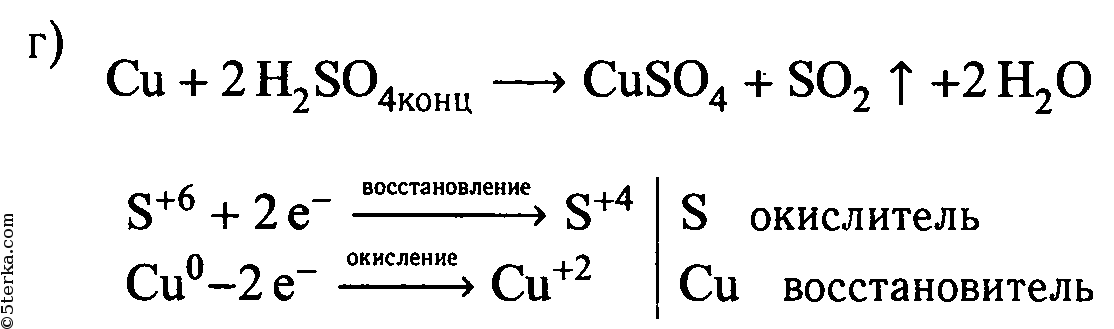
5. Проделайте реакции между следующими веществами:а) сероводородной и хлорной водой;б) раствором иодида калия и хлорной водой;в) соляной кислотой и алюминием;г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем и что — восстановителем?


6. Пользуясь растворами и веществами, находящимися на столе, получите:а) гидроксид железа (III);б) сульфид меди (II);в) оксид серы (IV);г) карбонат магния;д) свинец.
Составьте молекулярные и ионные уравнения соответствующих реакций.
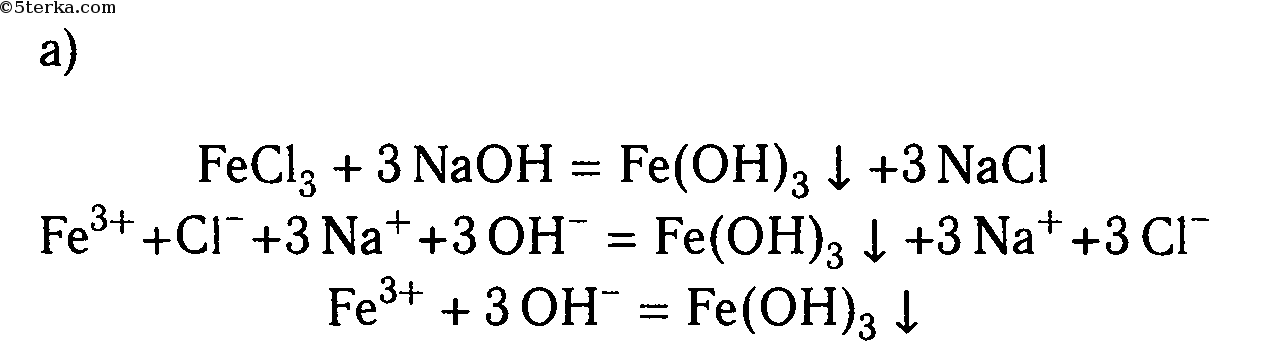

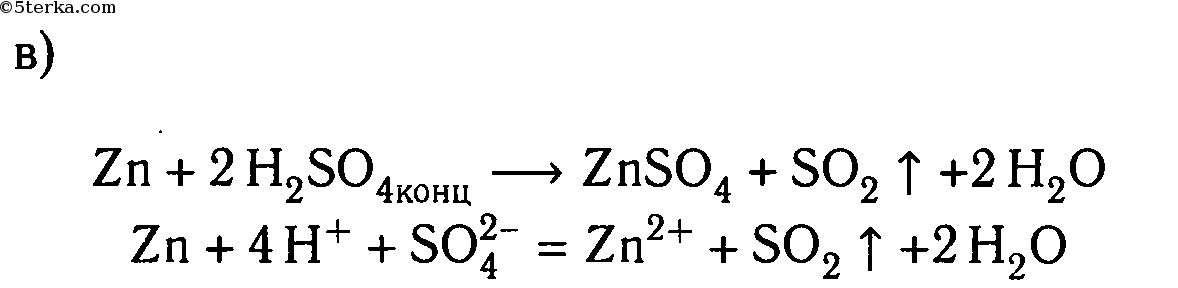

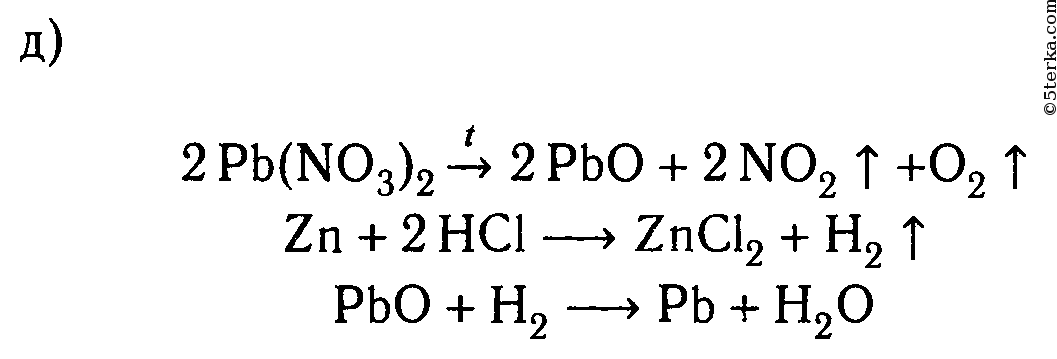
 Решебник
по
химии
за 8 класс (О.С.Габриелян, 2011 год),
Решебник
по
химии
за 8 класс (О.С.Габриелян, 2011 год),
задача №4
к главе «Глава 7. Свойства электролитов».