Опыт 1
Обнаружение сулъфат-ионов SO42-
В одну пробирку налейте 1—2 мл раствора сульфата натрия, а в другую — 1—2 мл раствора сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое.
Составьте уравнения электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите полное и сокращенное ионные уравнения реакции.
Какие соединения могут служить реактивом на ионы бария Ва2+?
В чем сущность обнаружения ионов с помощью реактива?

Сущность обнаружения ионов с помощью реактива заключается в том, что реакции с ними обнаруживаемого иона, избирательна для данного иона. Такая реакция называется аналитической. Аналитическая реакция сопровождается выделением газа, выпадением осадка или изменением цвета раствора.
Опыт 2
Обнаружение хлорид-ионов Cl
По таблице растворимости выясните, какие соли, содержащие хлорид-ион Cl-, нерастворимы (малорастворимы). При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы.
Составьте уравнения диссоциации солей, реакции обмена и полные и сокращенные ионные уравнения проведенных реакций.

Опыт 3
Обнаружение сульфат-ионов SO42-и хлорид-ионов Cl-
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой — раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну пробирку раствор нитрата свинца (II), в другую — раствор хлорида бария. В какой из пробирок выпал осадок? Какая из солей — KCl или MgSO4 — содержится в первой пробирке?
Раствор из второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (II). Объясните наблюдаемое.
Составьте уравнения реакций обмена проведенных вами реакций и полные и сокращенные ионные уравнения реакций обнаружения ионов.

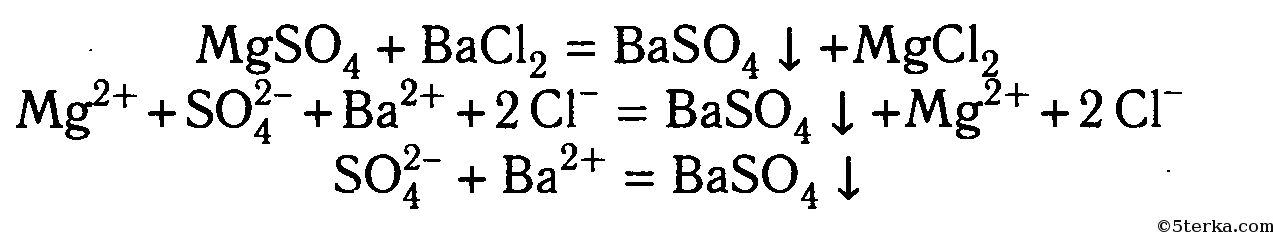
Опыт 4
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния; в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
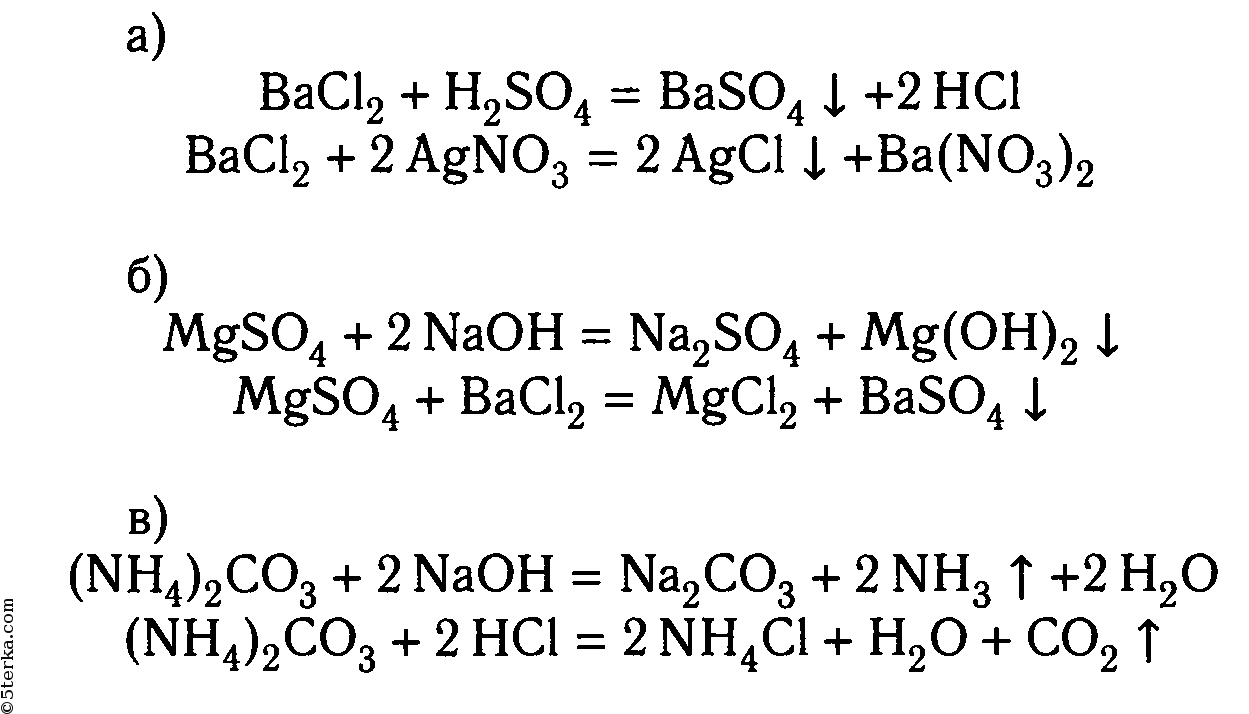
 Решебник
по
химии
за 8 класс (О.С.Габриелян, 2011 год),
Решебник
по
химии
за 8 класс (О.С.Габриелян, 2011 год),
задача №1
к главе «Глава 7. Свойства электролитов».