Оборудование. Штатив с пробирками, держатели и нагревательные приборы для пробирок, все для фильтрования, таблица растворимости кислот, солей и оснований.
Вещества. Растворы соляной, серной, азотной кислот; гидроксидов натрия, калия; карбоната калия, нитрата серебра, сульфата натрия, хлорида бария, сульфата меди (II), хлорида меди (II), хлорида кальция, хлорида железа (II), хлорида железа (III); карбонат кальция (мел, мраморная крошка); раствор лакмуса.
Примеры экспериментальных задач
1. Проведите реакции между растворами следующих веществ:а) карбонатом калия и азотной кислотой;б) хлоридом железа (III) и гидроксидом калия;в) гидроксидом натрия и серной кислотой;г) карбонатом кальция и соляной кислотой;д) хлоридом меди (II) и гидроксидом калия.
Напишите ионные уравнения реакций. Объясните результаты своих наблюдений.
2. Осуществите следующие превращения: сульфат меди (II)
→ гидроксид меди (II) → оксид меди (II) → хлорид меди (II).
Напишите уравнения реакций, укажите условия их протекания.
3. Проведите реакцию нейтрализации в присутствии лакмуса. Напишите полное и сокращенное ионные уравнения реакции. Объясните результаты своих наблюдений.
4. Используя имеющиеся на вашем столе реактивы, получите гидроксид железа (III) и выделите его из смеси.
5. Используя имеющиеся на вашем столе реактивы, получите посредством реакции обмена газообразное вещество. Напишите ионное уравнение реакции.
6. Проведите реакции, которые выражаются следующими сокращенными ионными уравнениями:
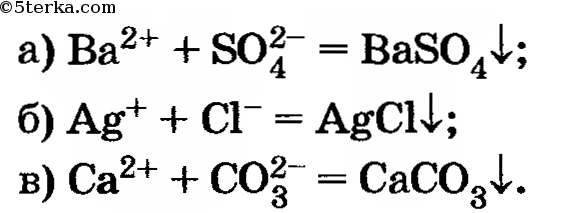
Напишите полные ионные уравнения реакций.
1.




д) Проведем реакцию между растворами CuCl2 и KOH.
CuCl2 + 2КОН = Cu(OH)2 darr;+ 2KCl При сливании растворов выпадает голубой студенистый осадок. Более сильное основание КОН вытесняет слабое и плохо растворимое Cu(ОН)2.
Ионные уравнения реакций:
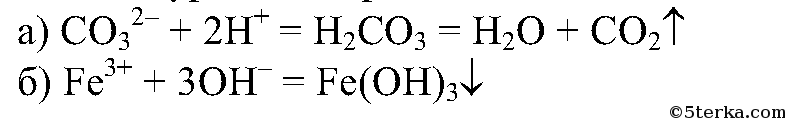
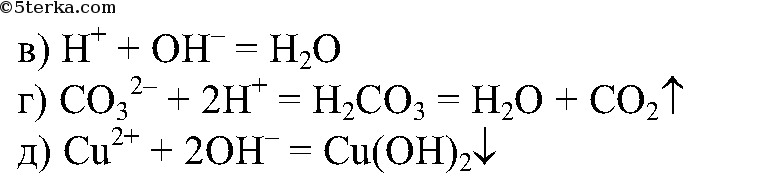
2.
Проведем следующие превращения:


В нейтральной среде лакмус окраску не меняет.
4.

5.
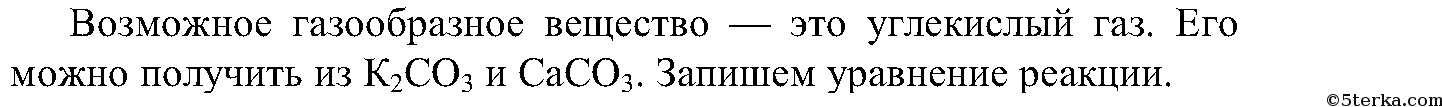
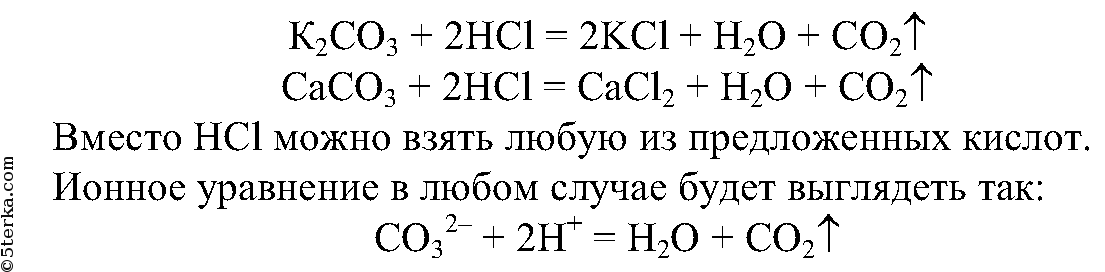
6.
Проведем несколько реакций:

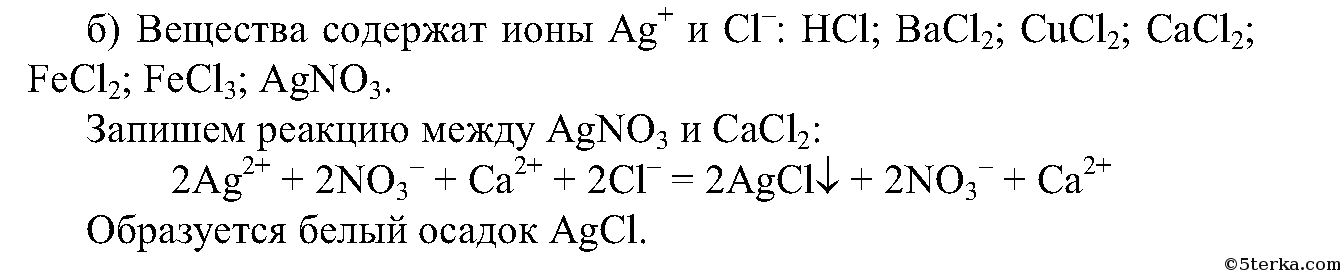
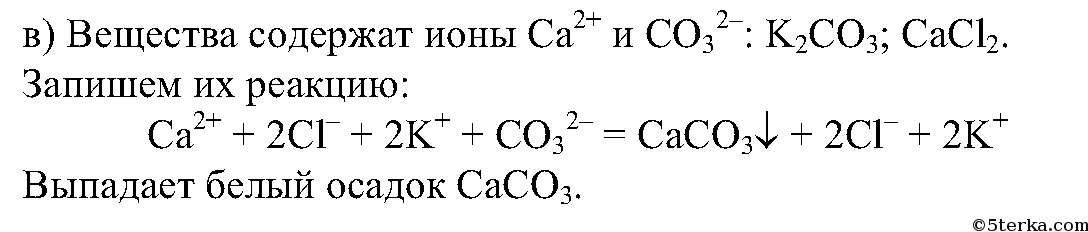
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №1
к главе «Практические занятия».