1) Различить: суперфосфат, нитрат аммония, сульфат аммония.
а) Действия: К содержимому пробирок добавляем воду. Наблюдения: В одной из пробирок вещество растворилось не полностью. Выводы: Это суперфосфат, так как он слабо растворим. б) Действия: К этому р-ру добавляем раствор нитрата серебра (I). Наблюдения: Выделяется желтый осадок. Уравнения реакции:
Выводы: В данной пробирке находится суперфосфат, т.к. данная реакция является качественной на фосфат -ионы. в) Действия: К оставшимся р-рам добавляем р-р хлорида бария. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции:


Выводы: В данной пробирке находится сульфат аммония, т.к. данная реакция является качественной на сульфат-ион. г) Действия: К веществу в оставшейся пробирке добавляем концентрированную серную кислоту и добавляем медь. Нагреваем. Наблюдения: Выделяется газ бурого цвета; раствор приобретает голубую окраску; медь растворяется. Уравнения реакции:

Выводы: В данной пробирке находится нитрат аммония, т.к. данная реакция является качественной на нитрат-ион.
2) Различить: хлорид аммония, нитрат натрия, хлорид калия.
а) Действия: К веществам добавляем раствор щелочи, нагреваем. Наблюдения: Из одной пробирки ощущается запах аммиака.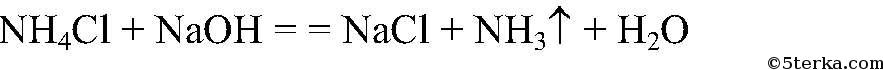
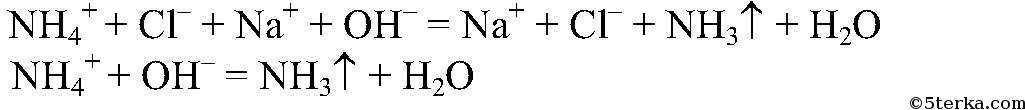
Выводы: В данной пробирке находится хлорид аммония, т.к. эта реакция является качественной на ион аммония. б) Действия: К двум оставшимся веществам добавляем раствор нитрата серебра (I). Наблюдения: В одной из пробирок белый осадок. Уравнения реакции:


Выводы: Эта реакция является качественной на

поэтому в данной пробирке содержится хлорид калия. в) Действия: К оставшемуся веществу добавляем концентрированную серную кислоту и добавляем кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета

раствор становится голубого цвета; медь растворяется. Уравнения реакции:

Выводы: В данной пробирке нитрат натрия, т.к. данная реакция является качественной на нитрат-ион.
Решение экспериментальных задач
1) Получите аммиак и проделайте с ним характерные химические реакции
(см. практическую работу №3).2) Получить двумя способами нитрат меди (II).
а) Действия: Берем оксид меди (II), добавляем
нагреваем. Наблюдения: Оксид меди (II) растворяется; раствор приобретает голубую окраску. Уравнения реакции:

б) Действия: Берем медь, добавляем азотную кислоту и нагреваем. Наблюдения: Медь растворяется; выделяется газ бурого цвета; раствор становится голубого цвета. Уравнения реакции:

4) Различить кристаллические вещества: Na2SO4, NH4Cl, NaNO3
а) Действия: К исследуемым веществам добавляем раствор щелочи. Наблюдения: Из одной пробирки ощущается запах аммиака. Уравнения реакции:
Выводы: В данной пробирке содержится хлорид аммония, т.к. проведенная реакция является качественной на ион аммония. б) Действия: К оставшимся в-вам добавляем р-р хлорида бария. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции:

Выводы: В данной пробирке находится сульфат натрия, т.к. эта реакция является качественной на сульфат-ион. в) Действия: К оставшемуся веществу добавляем концентриро-ванную серную кислоту и кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета; раствор становится голубого цвет ; медь растворяется. Уравнения реакции:

Выводы: Реакция является качественной на нитрат-ион, поэтому в данной пробирке находится нитрат натрия.
5) Различить растворы ортофосфорной и серной кислот
Действия: К обоим растворам добавляем нитрат серебра (I). Наблюдения: В одной пробирке наблюдается помутнение раствор , в другой образуется желтый осадок. Уравнения реакции: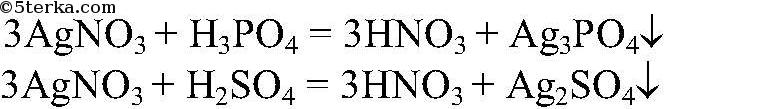
Выводы: Та пробирка, в которой образовался желтый осадок, содержит ортофосфорную кислоту, другая - серную.
6) Различить ортофосфаты натрия и кальция
Действия: Добавляем в обе пробирки воду. Наблюдения: В одной соль растворяется, в другой - нет. Выводы: Растворившаяся в результате реакции соль - ортофосфат натрия, не растворившаяся - ортофосфат кальция.
Источник:
 Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №0
к главе «Лабораторные и практические работы».
Комментарии