8*. МГУ96. Известно, что 40 мл раствора, содержащего нитрат меди (II) и серную кислоту, могут прореагировать с 25,4 мл 16,02%-ного раствора гидроксида натрия (плотность раствора 1,181), а прокаливание выпавшего при этом осадка дает 1,60 г твердого вещества. Вычислите концентрации (в моль/л) нитрата меди (II) и серной кислоты в исходном растворе, а также объем газа (при н. у.), который выделяется при внесении 2,5 г порошкообразной меди в 40 мл этого раствора.
1 В случае, если при величине плотности единица измерения не указана, обычно подразумевается г/см3.
Сначала напишем уравнения всех реакций: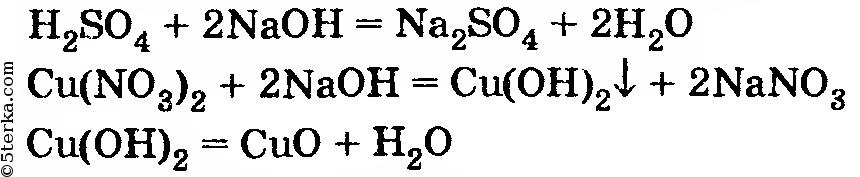
Составляем соотношения
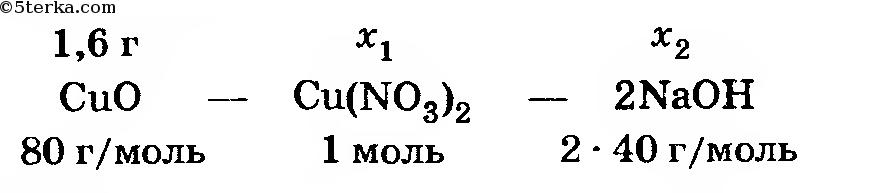
Отсюда находим

ответ на один из вопросов задачи.
Масса прибавленной щелочи:

1 В условии задания не даны единицы плотности, но приведенному значению, очевидно, соответствуют указанные нами единицы.
Масса щелочи, израсходованной на нейтрализацию серной кислоты:

Теперь найдем количество (число молей) серной кислоты из соотношений


- ответ на вто
рой из вопросов задачи.
Ответ на третий вопрос: никакой газ не выделится, так как 1 М серная кислота— это ~10%-ный раствор, а отнюдь не концентрированная кислота, с которой могла бы реагировать медь.
 Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
задача №8
к главе «Задачи к § 30.2».