16*. ММА95. Смесь оксида натрия и оксида калия общей массой 6 г растворили в 100 г 15%-ного раствора КОН. На нейтрализацию полученного раствора затрачено 72,89 мл 20%-ной соляной кислоты (пл. 1,1 г/мл). Вычислите, во сколько раз одного оксида было в смеси больше по массе, чем другого.
Соляная кислота нейтрализовала раствор, содержавший NaOH и КОН. Суммарное количество NaOH + КОН (число молей) равно количеству (молей) НСl, израсходованной в соответствии суравнениями реакций:
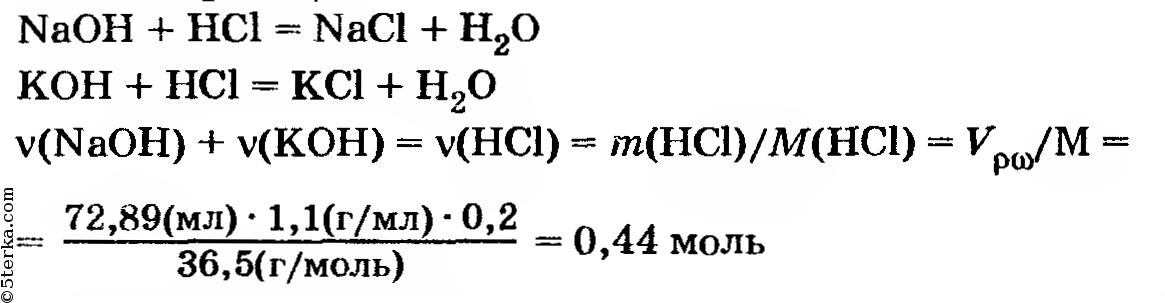
Чтобы определить количество вещества в исходной смеси оксидов, из полученной величины необходимо отнять количество вещества КОН, который уже был в растворе

Следовательно, из оксидов образовалось

Из каждого моля оксида натрия или калия получается два моля щелочи в соответствии с уравнением реакции

Следовательно, смесь оксидов содержит

вещества.
Обозначим массу оксида натрия в смеси х и оксида калия у. Составляем систему уравнений, в которой первое связывает массы оксидов, а второе — их количества:

Для рационального решения этой системы умножим второе уравнение на 94 и вычтем из него первое:

Отсюда

 Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
задача №16
к главе «Задачи к § 28.1».