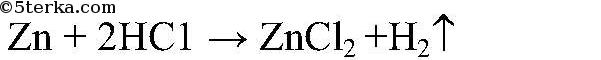 - скорость реакции высокая, т.к. соляная кислота обладает высокой химической активностью.
- скорость реакции высокая, т.к. соляная кислота обладает высокой химической активностью.
 - скорость реакции низкая, т. к.угольная кислота очень слабая. 2 ) Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.
- скорость реакции низкая, т. к.угольная кислота очень слабая. 2 ) Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ.

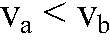 это можно наблюдать по скорости выделения газа. 3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
это можно наблюдать по скорости выделения газа. 3) Для веществ в твердом состоянии скорость реакции прямо пропорциональна поверхности реагирующих веществ.
 - эта реакция идет очень интенсивно, если использовать железный порошок. 4) При повышении температуры реакции на каждые 10
- эта реакция идет очень интенсивно, если использовать железный порошок. 4) При повышении температуры реакции на каждые 10
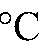 скорость большинства реакций увеличивается в 2-4 раза.
скорость большинства реакций увеличивается в 2-4 раза.
 - при обычных условиях реакция идет очень медленно, но при нагревании происходит взрыв.
- при обычных условиях реакция идет очень медленно, но при нагревании происходит взрыв.
 - эта реакция без нагревания почти не идет, при нагревании сульфид железа образуется достаточно быстро. 5) Скорость химических реакций зависит от присутствия некоторых веществ (катализаторов):
- эта реакция без нагревания почти не идет, при нагревании сульфид железа образуется достаточно быстро. 5) Скорость химических реакций зависит от присутствия некоторых веществ (катализаторов):
 - эта реакция идет достаточно быстро только в присутствии катализатора - раскаленной платиновой проволоки, она остается в состоянии красного каления в растворе аммиака вплоть до окончания реакции.
- эта реакция идет достаточно быстро только в присутствии катализатора - раскаленной платиновой проволоки, она остается в состоянии красного каления в растворе аммиака вплоть до окончания реакции.
Источник:
 Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №3
к главе «Глава III §§ 14 -16 стр. 43».
Комментарии