Возможно образование средней (уравнение 1) и кислой (уравнение 2) солей:
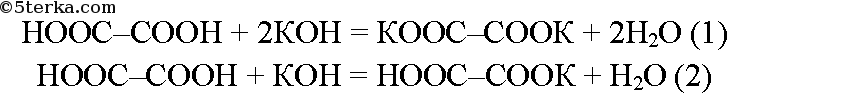
Вычислим массу гидроксида калия, содержащегося в растворе:

Вычислим молярную массу гидроксида калия:

Вычислим количество вещества гидроксида калия:
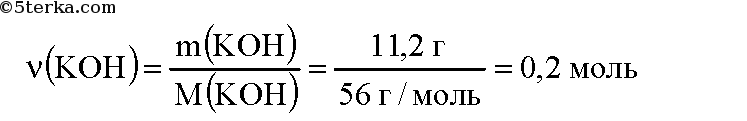
Молекулярная формула щавелевой кислоты С2Н2О4. Вычислим молярную массу щавелевой кислоты:

Вычислим количество вещества щавелевой кислоты:
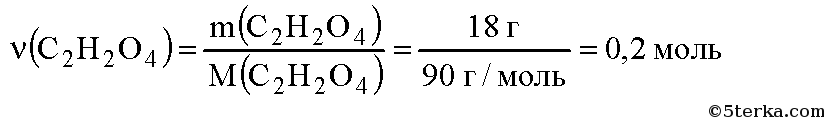
Таким образом, на 0,2 моль гидроксида калия приходится 0,2 моль щавелевой кислоты. Это соотношение соответствует уравнению (2), согласно которому для нейтрализации 1 моль гидроксида калия необходимо 1 моль щавелевой кислоты. Следовательно, образуется кислая соль - гидрооксалат калия. По уравнению 2 из 1 моль щавелевой кислоты образуется 1 моль гидрооксалата калия, следовательно из 0,2 моль щавелевой кислоты получится 0,2 моль гидрооксалата калия.
Молекулярная формула гидрооксалата калия С2НО4К. Вычислим его молярную массу:

Вычислим массу гидрооксалата калия:

Ответ: получится 25,6 г гидрооксалата калия НООС-СООК.
 Решебник
по
химии
за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),
Решебник
по
химии
за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),
задача №5
к главе «Глава VIII. Альдегиды и карбоновые кислоты §2 Карбоновые кислоты (стр. 113) Задачи».