№3. Вычислите, сколько граммов раствора, содержащего в массовых долях 0,7, или 70%, муравьиной кислоты, потребуется, чтобы нейтрализовать 2 кг раствора, содержащего в массовых долях 0,1, или 10%, гидроксида натрия. Какая соль и сколько граммов ее получится?
Уравнение реакции:
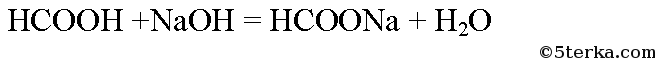
Образуется натриевая соль муравьиной кислоты - формиат натрия. Вычислим массу гидроксида натрия в растворе:

Вычислим молярную массу гидроксида натрия:

Вычислим количество вещества гидроксида натрия:

По уравнению реакции 1 моль гидроксида натрия взаимодействует с 1 моль муравьиной кислоты, при этом образуется 1 моль формиата натрия. Следовательно, для нейтрализации 5 моль натрия необходимо 5 моль муравьиной кислоты. Образуется 5 моль формиата натрия.
Молекулярная формула муравьиной кислоты СН2О2. Вычислим молярную массу муравьиной кислоты:

Вычислим массу муравьиной кислоты:

Для нейтрализации гидроксида натрия взяли раствор муравьиной кислоты с массовой долей 0,7. Вычислим массу раствора:

Молекулярная формула формиата натрия CHO2Na. Вычислим молярную массу формиата натрия:

Вычислим массу формиата натрия:

Ответ: необходимо 328,6 г раствора муравьиной кислоты, образуется 340 г формиата натрия.
 Решебник
по
химии
за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),
Решебник
по
химии
за 10 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 2000 год),
задача №3
к главе «Глава VIII. Альдегиды и карбоновые кислоты §2 Карбоновые кислоты (стр. 113) Задачи».