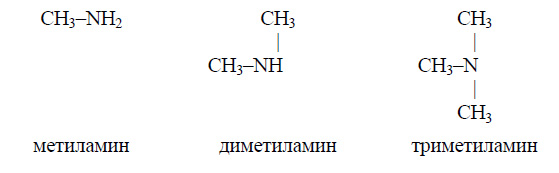Основные свойства аминов, как и аммиака, обусловлены наличием у атома азота неподеленной электронной пары. Поэтому, чем больше электронная плотность на атоме азота, тем сильнее выражены основные свойства амина. В молекуле метиламина атом азота соединен с метальным радикалом. Электроотрицательность водорода меньше, чем углерода и азота, поэтому происходит смещение электронов от трех атомов водорода к атому углерода и затем – к атому азота (на рисунке показано стрелками):
В результате электронная плотность на атоме азота увеличивается и метиламин является более сильным основанием, чем аммиак. В молекуле диметиламина атом водорода соединен с двумя метильными радикалами, и к атому азота передается электронная плотность от шести атомов водорода, поэтому электронная плотность на атоме азота больше, чем в молекуле метиламина, и диметиламин является более сильным основанием, чем метиламин. Наконец, в молекуле триметиламина три метильных радикала при атоме азота, и происходит смещение электронов к атому азота от девяти атомов водорода. Поэтому триметиламин является, в свою очередь, более сильным основанием, чем диметиламин. Таким образом, у метиламина основные свойства выражены слабее всего, а у триметиламина – сильнее всего.
 Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
Решебник
по
химии
за 11 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 2000 год),
задача №4
к главе «Глава XI. Амины. Аминокислоты. Азотсодержащие гетероциклические соединения».