Опыт 1
Влияние концентрации реагирующих веществ, температуры и катализатора на скорость взаимодействия иодида калия с пероксидом водорода:
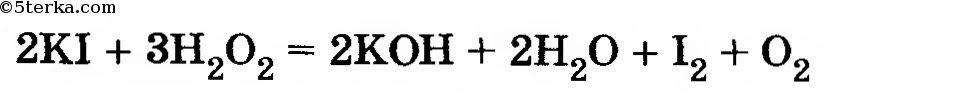
В четыре пронумерованные пробирки налейте по 3 мл раствора иодида калия разной концентрации и температуры согласно приведенной ниже таблице. Добавьте во все пробирки несколько капель крахмального клейстера для обнаружения иода. Затем прилейте, по возможности одновременно, во все пробирки по 2 мл пероксида водорода одинаковой концентрации. Наблюдения запишите в таблицу.
Выполнение работы:
В четыре пронумерованные пробирки налили по 3 мл раствора иодида калия разной температуры и концентрации, согласно приведенной ниже таблице. В каждую из пробирок добавили немного крахмального клейстера для обнаружения иода. Затем в каждую пробирку прилили немного пероксида водорода одинаковой концентрации. Наблюдения занесем в таблицу:

Опыт 2
Влияние температуры, давления и концентрации веществ на равновесие в системе:

а) Даны три пробирки, наполненные бурым NO2. Две из них закрыты пробками, а одна — поршнем. Оставив пробирку с поршнем как контрольную, погрузите одну пробирку с NO2 в горячую воду, а другую — в холодную. Через 2—3 мин сравните окраску газов в этих пробирках с контрольной и запишите наблюдения в таблицу. б) Быстро сожмите газ в пробирке поршнем на 2/3 ее объема. Как изменилась окраска газа при сжатии? Какой становится окраска газа через 2—3 с после сжатия? Быстро отпустите поршень в обратном направлении, уменьшая давление. Какой станет окраска газа через 5—6 с после расширения газов? Наблюдения отразите в таблице и сделайте выводы.
Выполнение работы:

|
Изменение окраски |
Смещение равновесия | |
|
Нагревание |
Цвет газа стал более насыщенным и темным |  |
|
Охлаждение |
Цвет газа побледнел, стал светло-желтым |  |
б) Быстро сжали газ в пробирке с поршнем. Через несколько секунд после сжатия цвет газа стал бледно-желтым. Быстро опустили поршень в обратном направлении. Через несколько секунд после расширения цвет газа вновь стал темно-бурым. Наблюдения занесем в таблицу.
|
Изменение окраски |
Смещение равновесия | |
|
Сжатие |
Цвет газа стал бледно-жёлтым |  |
|
Расширение |
Цвет газа стал темно-бурым |  |
Вывод: на химическое равновесие влияет температура, а также на системы с изменяющимся объемом влияет давление.
 Решебник
по
химии
за 11 класс (О.С.Габриелян, 2002 год),
Решебник
по
химии
за 11 класс (О.С.Габриелян, 2002 год),
задача №2
к главе «Глава 6. Химический практикум».



