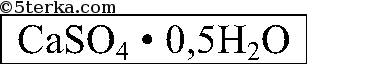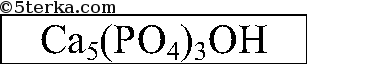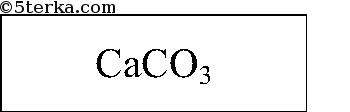Ознакомление с природными соединениями кальция
Задания. 1. Исследуйте образцы природных соединений кальция, изучите их некоторые физические свойства.
2. Осуществите превращения: СаСО3 → СаО → Са(ОН)2.
Оборудование. Штатив с пробирками, тигельные щипцы, горелка.
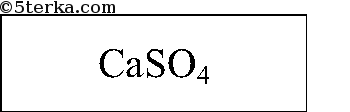
Вещества. Природные соединения кальция: гипс, ангидрит, фосфорит, мел, мрамор, известняк, другие кальциты.
Выполнение опыта
1. Рассмотрите выданные вам образцы природных соединений кальция. Исследуйте их физические свойства: цвет, твердость, кристаллическую форму, растворимость в воде (по таблице растворимости солей, оснований и кислот).
Результаты исследования оформите в виде таблицы:
2. Как вы, вероятно, отметили, известняки используются в основном для получения жженой извести (оксида кальция) и гашеной извести (гидроксида кальция). Осуществите эти превращения.
Соблюдайте правила техники безопасности при «гашении» жженой извести и работе с нагревательными приборами!
С помощью тигельных щипцов внесите в пламя горелки маленький кусочек известняка и нагрейте его до красного каления (1 мин). Положите полученную известь на подставку штатива для охлаждения.
Составьте уравнение реакции разложения известняка.
Налейте в пробирку 2 мл воды, добавьте 2—3 капли фенолфталеина и опустите в воду полученную жженую известь. Что вы наблюдаете? Составьте уравнение этой реакции.
1. Заполним таблицу:
2. Уравнения реакции:

Фенолфталеин окрашивает раствор в малиновый цвет.
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №21
к главе «Лабораторные работы и опыты».