Задание. Исследуйте взаимодействие алюминия с растворами кислоты и щелочи.
Соблюдайте правила техники безопасности при работе с кислотами и щелочами!
Оборудование. Штатив с пробирками, спички, лучина.
Вещества. Алюминий, соляная кислота (1:1), раствор гидроксида натрия (30%-й).
Выполнение опыта
1. Налейте в пробирку 2 мл соляной кислоты, опустите в нее алюминий. Что вы наблюдаете? Исследуйте газообразный продукт реакции с помощью горящей лучинки. Что происходит? Напишите уравнение реакции.
2. Налейте в пробирку 2 мл раствора гидроксида натрия, внесите в него алюминий. Наблюдайте за реакцией. Через некоторое время подожгите газообразный продукт реакции. Напишите уравнение протекающей реакции. Сделайте общий вывод о химических свойствах алюминия.
1.
Реакция сначала идет медленно, т.к. поверхность алюминия покрывает оксидный слой. После его растворения начинает реагировать сам металл. Появляются пузырьки газа, который можно поджечь, если отводить его через газоотводную трубку.

2.
Алюминий постепенно растворяется в щелочи:
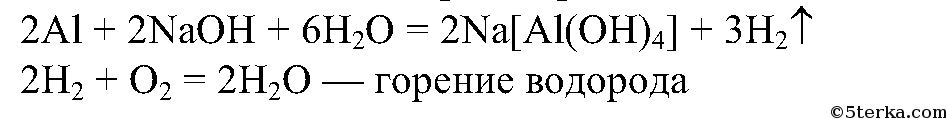
Вывод: алюминий — амфотерный металл, взаимодействует как с кислотами, так и с основаниями.
 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №17
к главе «Лабораторные работы и опыты».