Задания. 1. Изучите взаимодействие железа с кислотами и с солями.
2. Изучите взаимодействие оксида железа (III) с кислотами.
3. Получите гидроксиды железа с помощью реакций обмена и изучите свойства гидроксидов железа (II) и (III).
4. Осуществите превращение Fe(OH)2 → Fe(OH)3.
5. Проведите качественные реакции на ионы железа (II) и (III).
6. Установите, подвергается ли гидролизу сульфат железа (II).
Оборудование. Штатив с пробирками.
Вещества. Железо (гвоздь), 20%-е соляная и серная кислоты, оксид железа (III), растворы хлорида меди (II), хлорида железа (II), хлорида железа (III), гидроксида натрия, роданида калия KSCN, гексацианоферрата (III) калия K3[Fe(CN)6], хлорная вода, лакмусовая бумажка, дистиллированная вода (в стакане).
Выполнение работы
1. Налейте в одну пробирку соляную кислоту, в другую — серную. Внесите в каждую пробирку железо. Что вы наблюдаете? Напишите уравнения реакций, объяснив окислительновосстановительный процесс.
Налейте в пробирку раствор хлорида меди (II) и внесите в нее железный гвоздь. Что вы наблюдаете? Какой процесс происходит? Объясните его, напишите уравнения реакций.
2. Насыпьте в две пробирки небольшое количество оксида железа (III), затем в одну пробирку добавьте соляную кислоту, в другую — серную. Нагрейте содержимое пробирок. Что вы наблюдаете? Напишите ионные уравнения реакций.
3. Налейте в одну пробирку раствор хлорида железа (II), в другую — раствор хлорида железа (III) и добавьте в каждую пробирку раствор гидроксида натрия до образования осадка. Что вы наблюдаете? Напишите ионные уравнения проделанных реакций.
Разделите содержимое пробирок с гидроксидом железа (II) на три части, с гидроксидом железа (III) — на две части. Испытайте действие растворов соляной кислоты и гидроксида натрия на каждый из гидроксидов железа. Что вы наблюдаете? Напишите ионные уравнения проведенных реакций.
4. Наблюдайте, что происходит с течением времени в оставшейся пробирке, где находится гидроксид железа (II). Поясните наблюдаемые изменения. Напишите уравнение протекающей реакции.
5. Налейте в пробирку раствор хлорида железа (II) и добавьте раствор красной кровяной соли K3[Fe(CN)6]. Что вы наблюдаете? Налейте в пробирку раствор хлорида железа (III) и добавьте раствор роданида калия KSCN. Объясните наблюдаемое явление с помощью уравнения реакции.
6. В раствор сульфата железа (II) внесите фиолетовую лакмусовую бумажку. Что вы наблюдаете? Объясните наблюдаемое, напишите уравнение реакции.
1.
Наблюдается выделение газа. Этот газ — водород, который образуется при реакции:


2.
В обоих случаях оксид железа растворяется при нагревании:
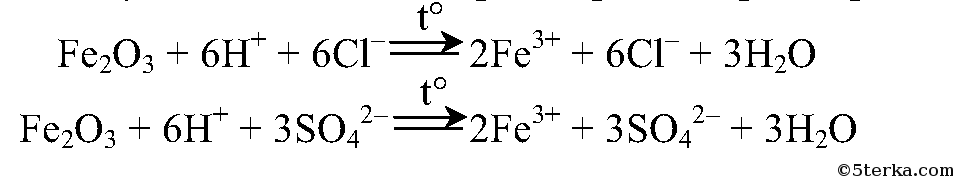
3.
В обеих пробирках образуются студенистые осадки.
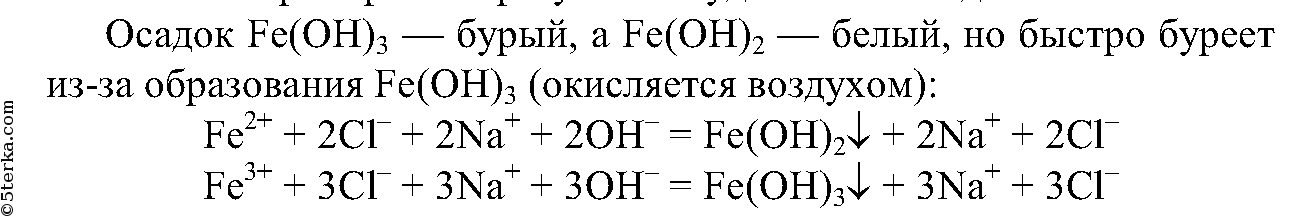

4.

5.
После сливания растворов образуется синий раствор.

Образовавшийся комплекс называется турнбуллева синь.
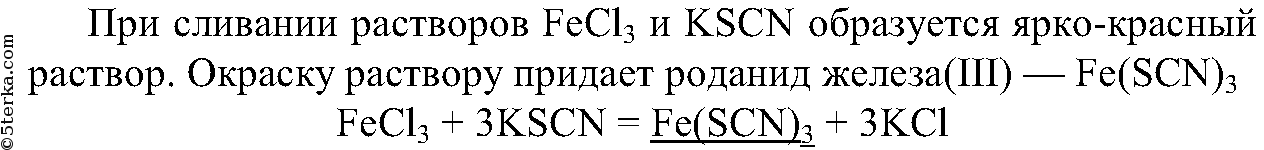
6.
В растворе происходит частичный гидролиз вещества.

 Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник
по
химии
за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №9
к главе «Практические занятия».