Основы молекулярно-кинетической теории к задачнику по физике за 10-11 классы «Физика. 10-11 класс. Пособие для общеобразовательных учебных заведений» Рымкевич А.П.
Основным положением молекулярно-кинетической теории является утверждение, что все тела состоят из мельчайших частиц (молекул, атомов и т.д.), которые движутся и взаимодействуют между собой. Доказательствами молекулярного строения вещества являются дробление тел, плавление, испарение, диффузия, броуновское движение и т.д.
Молярной массой M вещества называется масса такого количества молекул данного вещества, которое содержится в углероде 12C массой 12 г. Молярную массу вещества можно узнать по таблице Менделеева, сложив атомные массы всех атомов, входящих в молекулу этого вещества. При этом молярная масса будет измеряться в г/моль. Для перевода в систему СИ это значение следует умножить на 10-3. При этом молярная масса измеряется в кг/моль. Так, например, молярная масса водорода H2 равна 2 г/моль=2⋅103 кг/моль.
В одном моле любого вещества содержится NA = 6,022⋅1023 моль-1 молекул. Число NA называется постоянной Авогадро. Масса одной молекулы m0 выражается формулой

Количеством вещества v называется отношение числа молекул N к числу Авогадро NA :
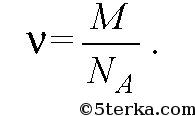
Если m — масса вещества, то

Идеальным газом называется газ, в котором молекулы движутся свободно и взаимодействуют между собой и со стенками сосуда только при столкновениях. Модель идеального газа удовлетворительно описывает достаточно разреженные газы.
Среднеквадратичной скоростью молекул

называется следующая физическая величин
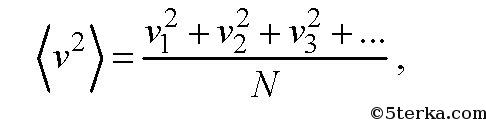
где v1, v2, v3,... — скорости молекул: первой, второй, третьей, и так далее до N. Отметим, что средняя скорость молекул равна нулю и не равна
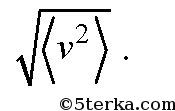
Концентрацией молекул n называется отношение числа молекул N в объеме V к этому объему V:
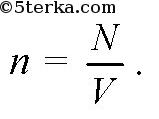
Давление p можно выразить следующей формулой

Это уравнение носит название основного уравнения молекулярно кинетической теории (МКТ) газов. Это уравнение можно переписать в виде
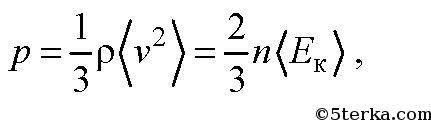
где ρ — плотность газа,
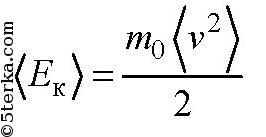
— средняя кинетическая энергия молекулы газа. Средняя кинетическая энергия

связана с температурой T газа формулой
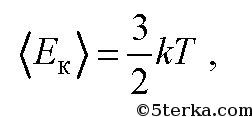
где k—постоянная Больцмана. Она численно равна

Можно доказать следующую формулу:

Из нее следует уравнение Менделеева-Клапейрона

где

— универсальная газовая постоянная.
При неизменной массе и составе газа

Если же постоянна еще и температура, то

(изотермический процесс), если давление постоянно, то

(изобарический процесс), если объем постоянен, то
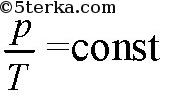
(изохорический процесс).
Водяной пар всегда присутствует в атмосфере Земли, как малая примесь, но он во многом определяет погоду. Влажность воздуха можно характеризовать парциальным давлением пара p или плотностью пара ρ (абсолютная влажность). Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью. При определенной температуре существует такое давление, при котором водяной пар становится насыщенным. Такое давление рнас называется давлением насыщенного пара. Это давление можно найти по таблице в задачнике. Относительной влажностью φ называется отношение парциального давления пара p к давлению насыщенного пара

Если ρнас — плотность насыщенного пара, то
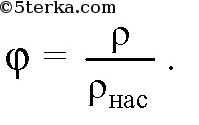
В жидкостях имеет место явление поверхностного натяжения. Оно состоит в том, что жидкость стремится уменьшить свою энергию, минимизировав поверхность. Как известно, из всех тел заданного объема минимальной поверхностью обладает шар. Именно поэтому жидкость в невесомости приобретает шарообразную форму. Сила поверхностного натяжения F, действующая на тело длины l, выражается формулой
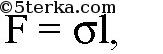
где σ — коэффициент поверхностного натяжения.
Пусть имеется твердое тело длинной l с площадью поперечного сечения S, которое под действием силы F удлинилось на Δl. Тогда имеет место формула

где

напряжение в теле, Е — константа, которая называется
модулем Юнга,
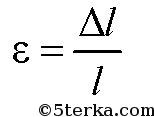
— относительное удлинение.