
Массу гидроксида бария найдем из пропорции

Отсюда количество гидроксида бария

Возможные реакции:


(Мы не рассматриваем возможность образования основного фосфата бария, так как он не существует из-за неминуемой реакции
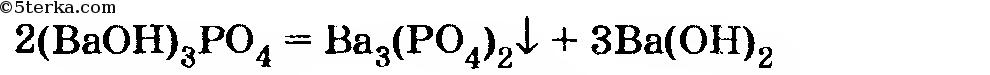
с выпадением осадка.)
Исходные количества реагентов не соответствуют ни одному из написанных уравнений. При этом уравнение 3 можно вообще не рассматривать, так как соответствующая реакция требует, чтобы выполнялось условие

а здесь наоборот
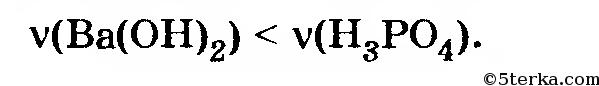
Вывод: образуется смесь веществ Ва(Н2РO4)2 и ВаНРO4. Чтобы вычислить их количества, можно исходить из любой из двух первых реакций. За исходное уравнение удобнее принять уравнение 2.
В этой реакции на имеющееся количество гидроксида бария (0,002 моль) расходуется столько же фосфорной кислоты и образуется 0,002 моль гидрофосфата. Остается в избытке кислота
0,003 - 0,002 = 0,001 моль Н3РO4, и она вступает в реакцию
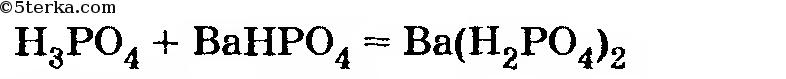
В этой реакции на 0,001 моль Н3РO4 расходуется столько же ВаНРO4 и образуется столько же Ва(Н2РO4)2.
Таким образом, в полученном растворе количества веществ (соединений бария) равны:
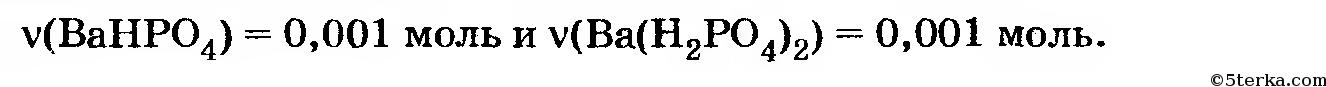
 Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
Решебник
по
химии
за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
задача №13
к главе «Задачи к § 25.5».